眼药水召回2023年和感染是由于缺乏FDA监管 - 彭博报道
Peter Robison, Priyanka Pulla
 摄影师:Ina Jang for Bloomberg Businessweek铜绿假单胞菌是一种长度仅为几分之一毫米的杆状细菌。在培养皿中,它散发着玉米玉米饼的气味。它是一种机会主义者,侵入任何已经受损的组织,并且可能致命:在特别脆弱的人群中, 死亡率可能高达50%。但也许这种细菌最显著的特征是它有多难以杀死。最顽强的铜绿假单胞菌是抗生素耐药的超级细菌,无论医生使用什么药物,它们都会继续肆虐。
摄影师:Ina Jang for Bloomberg Businessweek铜绿假单胞菌是一种长度仅为几分之一毫米的杆状细菌。在培养皿中,它散发着玉米玉米饼的气味。它是一种机会主义者,侵入任何已经受损的组织,并且可能致命:在特别脆弱的人群中, 死亡率可能高达50%。但也许这种细菌最显著的特征是它有多难以杀死。最顽强的铜绿假单胞菌是抗生素耐药的超级细菌,无论医生使用什么药物,它们都会继续肆虐。
 2022年5月,一种异常凶猛的菌株首次出现在美国,出现在洛杉矶的一名医院患者身上。整个夏天,又出现了三起本地病例。随着医生们试图对抗这种细菌,疾病控制和预防中心开始跟踪它,审查患者共同拥有的每个地点和物品。铜绿假单胞菌甚至可以在从未接触过原始来源的人群中传播。这种细菌出现在康涅狄克州,然后是犹他州。它出现在人们的肺部和血液中。机构花了八个月的时间 确定罪魁祸首:非处方眼药水。这两个受影响的品牌在价格不到知名品牌的一半的情况下广泛销售。它们不是假冒的。它们没有非法进口。它们是在印度生产的,并由两家美国经销商销售,盒子上印有食品和药物管理局发放的药物库存编号。
2022年5月,一种异常凶猛的菌株首次出现在美国,出现在洛杉矶的一名医院患者身上。整个夏天,又出现了三起本地病例。随着医生们试图对抗这种细菌,疾病控制和预防中心开始跟踪它,审查患者共同拥有的每个地点和物品。铜绿假单胞菌甚至可以在从未接触过原始来源的人群中传播。这种细菌出现在康涅狄克州,然后是犹他州。它出现在人们的肺部和血液中。机构花了八个月的时间 确定罪魁祸首:非处方眼药水。这两个受影响的品牌在价格不到知名品牌的一半的情况下广泛销售。它们不是假冒的。它们没有非法进口。它们是在印度生产的,并由两家美国经销商销售,盒子上印有食品和药物管理局发放的药物库存编号。
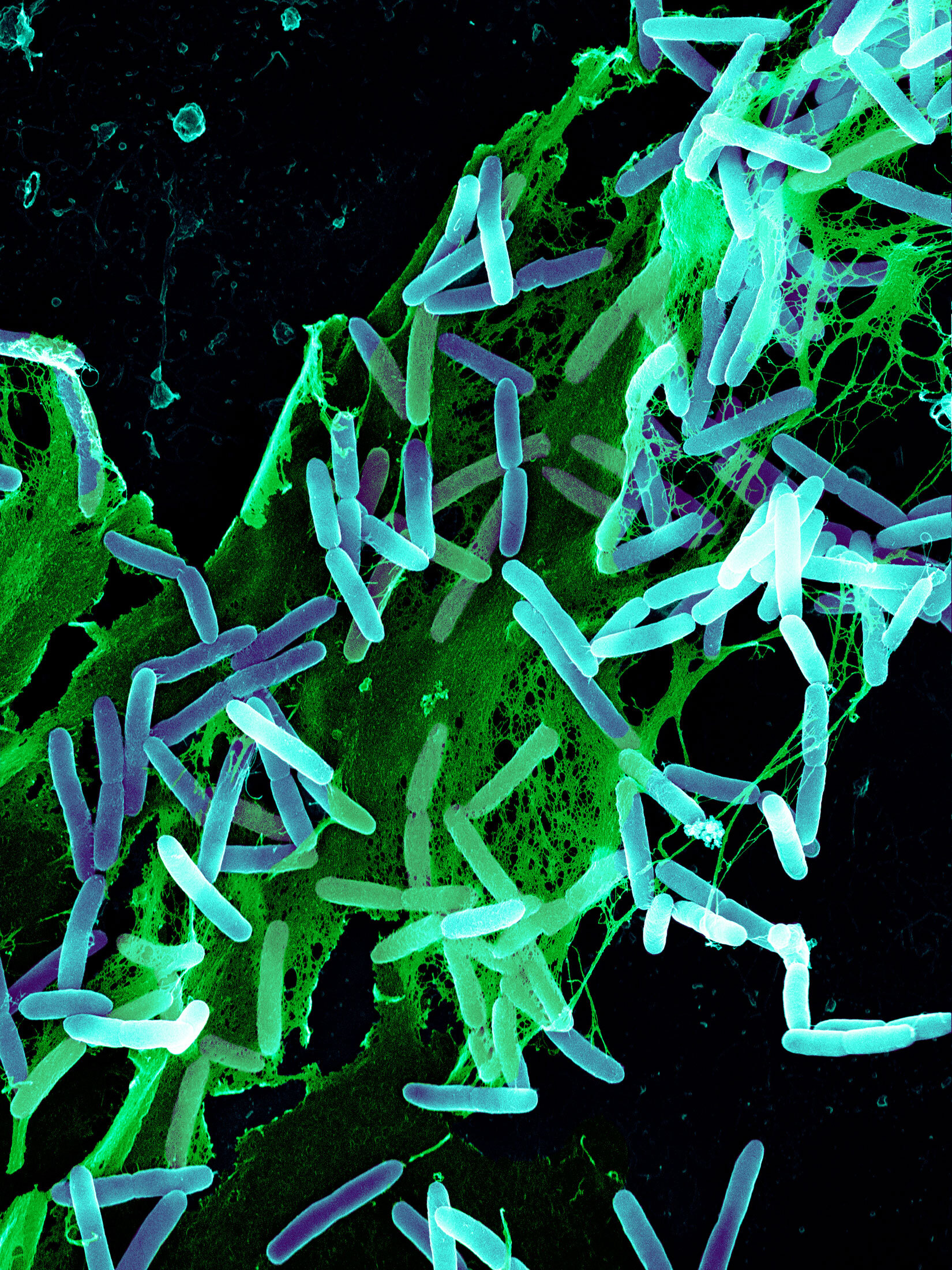 铜绿假单胞菌细菌(蓝色),被白细胞吞噬。来源:科学图片库/科学来源 EzriCare LLC和Delsam Pharma LLC的眼药水在铜绿假单胞菌导致四人死亡、18人视力丧失和大量感染后被召回。具体情况令人震惊。有四人细菌传播得如此之快,以至于医生不得不切除他们的眼球以阻止细菌蔓延。其他人的角膜变成了混浊的脓肿疤痕。一些人忍受着偏头痛、眼睛分泌物和光敏感,使他们在黑暗中度过了数天甚至数月。
铜绿假单胞菌细菌(蓝色),被白细胞吞噬。来源:科学图片库/科学来源 EzriCare LLC和Delsam Pharma LLC的眼药水在铜绿假单胞菌导致四人死亡、18人视力丧失和大量感染后被召回。具体情况令人震惊。有四人细菌传播得如此之快,以至于医生不得不切除他们的眼球以阻止细菌蔓延。其他人的角膜变成了混浊的脓肿疤痕。一些人忍受着偏头痛、眼睛分泌物和光敏感,使他们在黑暗中度过了数天甚至数月。
导致疫情爆发的原因是FDA对非处方药监管存在严重漏洞。长期以来,这些药物一直是该机构的最低优先级之一——假设即使它们不起作用,也可能不会致人死亡。这些药物基本上是在诚信制度下生产和销售的。公司不必向机构证明其药物是安全有效的,或者正在符合良好的生产条件。没有涉及测试;也不需要检查。公司只需声明正在使用批准的成分并遵守良好的生产规范。基本上,只是一些文书工作。
事实证明,这些受污染的眼药水是由两位经验不足的企业家销售的,他们互不相识,但找到了同一家位于印度金奈的小公司来生产这种据称是无菌的药物。Ezriel Green是新泽西州的批发药品经销商;Kuppusamy Arumugam是纽约布朗克斯的药剂师。在眼药水之前,他们都从未销售过自己的药物。记录显示,他们的制造商,Global Pharma Healthcare Pvt Ltd.,从未向美国出口过任何药物。眼药水必须保证无菌,这是一个严格且昂贵的过程。Global Pharma被允许运送数十万瓶眼药水,而无需FDA检查其工厂。
眼药水被宣传为不含防腐剂。但这意味着它们也缺乏防止细菌生长的化学物质。大多数制造商只在单次使用的小瓶或专门设计的多次使用瓶中销售这种眼药水,以保持无菌状态。这两种方式成本更高。Global Pharma的无防腐剂眼药水装在常规、更便宜的瓶子中,含有多剂。
美国食品药品监督管理局(FDA)用于列出非处方药的自动化流程没有标记出这个关键缺陷。它也没有发现其他警告信号:制造商和分销商的背景不够实质。FDA发言人杰里米·卡恩表示,该机构会停用不符合要求的列出,并正在努力改进监测方式。他表示,该机构的“最高优先事项是保护公共健康”,包括推荐和协调自愿召回、发送公共通知、检查和与公司进行讨论。至于受污染的眼药水,他表示该机构正在监控情况。
仿制药行业已经遍布全球以生产廉价药物。监管机构没有跟上:在一些地方规则没有得到执行,在其他地方规则不足。结果是短缺、召回和健康风险。美国食品药品监督管理局在2022年宣布了900多次召回,是四年前的三倍。印度,占全球仿制药供应的五分之一,因质量问题受到越来越多的关注。例如,仿制癌症药物的生产失误导致今年出现了可能拯救生命的治疗药物短缺,让患者等待。世界卫生组织将去年冈比亚60多名儿童的死亡与印度生产的有毒药水联系起来。
 Global Pharma在金奈附近的工厂。摄影师:Priyanka Pulla印度政府激烈捍卫其出口强国地位。他们中断了对药水中毒素来源的调查。当地官员也为Global Pharma辩护。这种立场以及全球供应链中最常见药物的监管漏洞正在危害全球人民。
Global Pharma在金奈附近的工厂。摄影师:Priyanka Pulla印度政府激烈捍卫其出口强国地位。他们中断了对药水中毒素来源的调查。当地官员也为Global Pharma辩护。这种立场以及全球供应链中最常见药物的监管漏洞正在危害全球人民。
当FDA检查员最终于二月进入Global Pharma的无菌加工设施时,他们发现灌装机中有棕色残留物,未经培训的工人穿着脏兮兮、重复使用的鞋套。那时,Global Pharma已自愿召回其眼药水。FDA检测了未打开的EzriCare眼药水瓶,发现其中被细菌污染,但尚未明确识别细菌或其来源。Global Pharma表示他们没有责任。
“美国公众应该知道,没有人在关注这个问题。FDA没有资源来做这件事并不是他们的错。但他们不应该假装他们能够做到。”
Kuppusamy Arumugam于1977年从印度移民后获得了他的药剂师执照。如今,他在布朗克斯经营Farmacia Central。这是一家狭窄的商店,陈列着各种通用药品,就像纽约的一家小杂货店,还有家庭日用品。Ezriel Green在布鲁克林长大,在一所犹太教学院获得了犹太法研究硕士学位,然后从事商业——首先销售血糖试纸,然后是冷切肉类。2016年,他创立了EzriRx,一家在线批发药品分销商,四年后,成立了EzriCare,以自己的品牌名称分销药品。
询问他们是如何在2020年内相继销售由同一制造商制造的成分相同的眼药水的,而这些解释引发了许多问题。
Arumugam在2020年7月开始推广他的眼药水,正值新冠疫情早期。一些药物供应短缺,一些被囤积,但他表示他并没有考虑这些。他提供了几个关于他进入这个行业的版本,其中一个版本是因为有一个客户拖欠了他订购的眼药水,而所有版本的结局都是他通过印度的一名顾问与Global Pharma取得联系。在另一名顾问的帮助下,他通过FDA的电子清单系统注册了Delsam Pharma的人工泪液。标签描述它们与畅销品牌Refresh Plus相似,不含防腐剂,以单次使用小瓶销售。四个月后,Green的公司也使用顾问注册了成分相同、描述方式相同的EzriCare人工泪液。Green的律师表示,他依赖Global Pharma和一名中间人,后者去年去世,其公司今年宣布破产,来处理一切,现在他知道相信他们是错误的。“EzriCare对最近有报道的毒性、破坏性眼部感染受影响的个人表示哀悼,”律师Rick Lauer在一封电子邮件中写道。
 2019年的绿色。摄影师:道格·胡德/美国今日网络这些是全球制药公司眼药水在美国的不太可能的分销商,能够开始销售一种敏感产品,而没有人询问他们关于其安全性的任何问题。
2019年的绿色。摄影师:道格·胡德/美国今日网络这些是全球制药公司眼药水在美国的不太可能的分销商,能够开始销售一种敏感产品,而没有人询问他们关于其安全性的任何问题。
当前的OTC系统可以追溯到1972年,当时FDA意识到需要一种更有效的方式来跟上所有生产的非处方药,包括止痛药、药膏和止咳糖浆。为了制定OTC产品的标准,FDA邀请专家为每个类别推荐安全的成分;他们创建的专论就像食谱书。但是,讨论需要数年,有时甚至几十年。 眼药水的专论最终于1988年完成,就像是美国商业的另一个时代的时光胶囊,提到了早已关闭或转移到海外的国内制造商。
FDA的自动化系统对EzriCare和Delsam Pharma列出他们的眼药水只有几个基本要求:药品名称;剂量;成分;以及标签的图像,包括有关使用和警告的信息,这些信息通常随每种药物提供。然后,每种产品被分配一个独特的国家药物代码,出现在国家卫生研究院维护的在线医学图书馆中。全球制药注册为他们的制造商。就是这样。
对于那些愿意查看的人,列表上有一个免责声明,清楚地说明FDA尚未批准或审查该药物。但公司并不需要在他们的广告中包含这一信息,而且通常会找到方式暗示完全相反。
联系我们
彭博调查正在调查药品质量。 *如果您在这个行业工作,或者有信息可以帮助我们进行持续报道,请发送电子邮件至:*[email protected]
进入美国市场对全球制药公司来说是一件大事。该公司成立于1986年,由文卡特什·拉真德兰(Venkatesh Rajendran)领导,他曾接受过医生培训,被同行描述为温和且受欢迎。拉真德兰也有着广泛的人脉:直到去年,他还是印度商务部设立的一个顶级委员会Pharmexcil的成员,该委员会是一个有影响力的贸易团体,旨在促进药品出口。尽管如此,全球制药并不是印度500亿美元药品行业的核心。几十年来,该公司向东南亚和非洲约两打个国家销售药品;其产品包括注射用抗生素和眼药水,这两者都需要无菌生产。了解拉真德兰的人表示,进入美国市场的一个吸引点是有潜力以更高的利润销售大量产品。根据其最近的年度报告,该公司的收入在过去五年中增长了近50%,但仍然只有6.74亿卢比(820万美元)。
该公司的工厂位于钦奈郊外的一个制药园区,这是泰米尔纳德邦唯一的一个制药园区。根据三位熟悉全球制药的人士的说法,他们不愿透露身份以保护与该公司和印度监管机构的关系,该设施被认为适用于他们所称的“半规范”或“较低规范”的市场,这些市场的测试和检查要求低于美国或欧洲。其中一位大约五年前参观过全球制药运营的人将其描述为尚可,但仅“足够满足第三世界的要求”。拉真德兰拒绝回应这些描述,也不回答有关工厂当前状况的问题。
全球制药公司在2021年1月向Arumugam的公司发送了10万瓶人工眼泪,根据追踪全球航运数据的公司ImportGenius。另外在2021年9月和2022年5月,几乎有50万瓶被送到了EzriCare的进口商那里。
Green特别为他公司的包装感到自豪。“我们的理念是,价格便宜的优质非处方药也应该看起来不错,”Green在去年的LinkedIn帖子中写道。
即使在美国没有对大多数非处方药进行审查,也有办法后续跟踪问题。印度等许多国家缺乏报告机制和监测网络来证明某种药物导致死亡或疾病,印度最大的仿制药生产商之一Dr. Reddy’s Laboratories Ltd.的全球质量主管Ganadhish Kamat在2021年退休时表示。“当有人死亡时,人们会说,‘天意’—‘这是上帝的意愿’—或者‘出了什么问题。反正他已经老了,’”他说。“而在美国,他们会追踪历史和不良事件。他们会尝试将其与某种药物联系起来。”
 Renee Martray因假单胞菌感染导致右眼视力模糊。摄影师:Kathleen Robbins,彭博商业周刊2022年5月,洛杉矶县一家医院出现了第一位眼睛发炎、流出黄脓的患者。医院确定眼睛感染了一种对抗生素高度耐药的假单胞菌菌株,并将其报告给当地卫生官员。到8月,另外三个最近去过同一眼科医生处的人也被感染。洛杉矶县官员致函CDC的抗菌耐药团队负责人Maroya Walters。 机构估计,耐药细菌每年在美国造成280万感染和多达3.5万死亡。“这听起来像是一项有趣且不寻常的调查,”她回复道,敦促他们审查患者的病史以及是否曾出国旅行。洛杉矶县官员调查了眼科医生办公室的压力计或其他设备是否被污染。
Renee Martray因假单胞菌感染导致右眼视力模糊。摄影师:Kathleen Robbins,彭博商业周刊2022年5月,洛杉矶县一家医院出现了第一位眼睛发炎、流出黄脓的患者。医院确定眼睛感染了一种对抗生素高度耐药的假单胞菌菌株,并将其报告给当地卫生官员。到8月,另外三个最近去过同一眼科医生处的人也被感染。洛杉矶县官员致函CDC的抗菌耐药团队负责人Maroya Walters。 机构估计,耐药细菌每年在美国造成280万感染和多达3.5万死亡。“这听起来像是一项有趣且不寻常的调查,”她回复道,敦促他们审查患者的病史以及是否曾出国旅行。洛杉矶县官员调查了眼科医生办公室的压力计或其他设备是否被污染。
那个夏天,疾控中心还得知犹他州和康涅狄格州的养老院有30多人感染了铜绿假单胞菌。大多数人没有显示任何症状;这种细菌是在例行筛查中被检测出来的。其他人的肺部或痰中有这种细菌,而不是眼睛。
沃尔特斯和她的疾控中心工作人员最初猜想这些病例与每个地方都去过的医护人员或患者有关。对医疗记录的审查排除了这种可能性。9月,一名70多岁的男子在华盛顿州的医院住院期间死于血流感染。四个州的感染病例表明,传播的铜绿假单胞菌来自同一种产品。
疾控中心团队开始费力地收集患者使用过的每种产品的品牌名称、批号和制造商。沃尔特斯考虑到问题甚至可能是一个常见的成分。2022年3月,在挪威,至少有七人死于另一种铜绿假单胞菌菌株,这与一家英国制造商生产的受污染的预湿毛巾有关。她和她的工作人员询问了湿巾、乳霜、洗液、药膏、沐浴产品、泻药和眼药水。没有一个产品引人注目。仅就人工泪液而言,他们记录了使用了十多个品牌。然后,在11月初,他们得知了一起在迈阿密巴斯康·帕尔默眼科研究所困扰医生数月的罕见的耐药感染簇。
该研究所每年看到多达一千例严重的角膜感染病例,该所的专家之一Guillermo Amescua说。通常,他们可以找到一些药物组合来治疗这些感染。但对于这些感染,他们却束手无策。
退休的化妆师克拉拉·奥利瓦(Clara Oliva)于八月份来到医院,右眼泪流满面且肿胀。那是她的好眼睛;她的左眼从小视力就很差。医生进行了一种用光和化学物质杀灭细菌的治疗。他们尝试了抗真菌药物。他们插入针头从眼睛排出液体。但都没有奏效。每次奥利瓦回来时,角膜上的脓肿都在增长。到了九月,医生担心感染会蔓延到她的全身,于是用塑料植入物替换了她的右眼。现在,奥利瓦合法失明,搬到了一个儿子那里,儿子帮助照顾她。
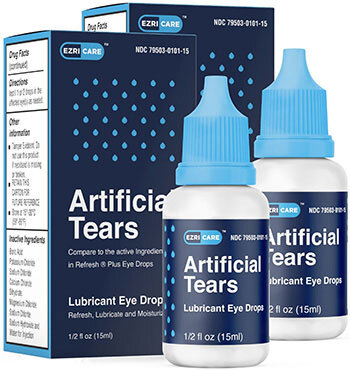 EzriCare人工眼泪。那年夏天,南卡罗来纳州莱克星顿的行政助理雷妮·马特雷(Renee Martray)和她的未婚夫准备去宾夕法尼亚州露营。他忘记带手电筒,她忘记带眼药水。她在路上买了一些EzriCare人工眼泪。她之前从未听说过EzriCare,也没有太在意标签,只看价格。“我从来没有考虑过品牌名称,”马特雷说。“现在我想到了。”他们回家几天后,她的右眼变红肿,未婚夫敦促她去看医生。抗生素有所帮助。没有人怀疑EzriCare眼药水可能有问题,所以她继续使用。到了十二月,她的眼睛开始灼烧。这一次,疼痛和肿胀很难治疗。她说她被诊断为感染了同一种假单胞菌。角膜瘢痕最终使她的右眼变得模糊,导致头痛和感觉就像透过一扇弄脏的窗户看东西。她不得不辞去工作,她说很难离开家。
EzriCare人工眼泪。那年夏天,南卡罗来纳州莱克星顿的行政助理雷妮·马特雷(Renee Martray)和她的未婚夫准备去宾夕法尼亚州露营。他忘记带手电筒,她忘记带眼药水。她在路上买了一些EzriCare人工眼泪。她之前从未听说过EzriCare,也没有太在意标签,只看价格。“我从来没有考虑过品牌名称,”马特雷说。“现在我想到了。”他们回家几天后,她的右眼变红肿,未婚夫敦促她去看医生。抗生素有所帮助。没有人怀疑EzriCare眼药水可能有问题,所以她继续使用。到了十二月,她的眼睛开始灼烧。这一次,疼痛和肿胀很难治疗。她说她被诊断为感染了同一种假单胞菌。角膜瘢痕最终使她的右眼变得模糊,导致头痛和感觉就像透过一扇弄脏的窗户看东西。她不得不辞去工作,她说很难离开家。
到年底,康涅狄格州的CDC调查员取得了突破,开始测试养老院剩余的开瓶眼药水。一月份的初步结果显示,在两个州的七瓶EzriCare开瓶眼药水中发现了耐药细菌,CDC尚未公布这两个州的名称。CDC在1月20日向医生发布了一份公告,敦促他们立即停止使用EzriCare人工眼泪。
北卡罗来纳州的眼科医生桑德拉·布朗在美国眼科学会的一封电子邮件中看到了这则通知。布朗还是西雅图外的非营利组织干眼基金会的董事会成员,该组织发布了有关眼药水安全建议。EzriCare多次使用瓶本身就是布朗发现问题的第一个迹象。她说,这个瓶子做得太便宜了,甚至没有尖端的穿孔。它更像是一瓶超级胶水:瓶盖内部有一个尖牙,人们可以用来自己打孔。布朗想知道这个尖牙是否可能是污染的源头。
她对CDC选择以如此低调的方式发送这个看似如此重要的通知感到惊讶。她和基金会主席丽贝卡·佩特里斯继续发出了自己的警报。他们在1月23日发布了一段视频,描述了包装上的缺陷可能违反了一项联邦法律,该法律要求在多剂量瓶中出售的眼药水必须使用适当的防腐剂或包装,以最大程度地减少污染风险。
 佩特里斯在她的干眼商店储藏室里。摄影师:Chona Kasinger,彭博商业周刊EzriCare的律师回复基金会的一封停止和撤回信,基金会随后撤下了视频。当时,Arumugam说,有人(他不记得是谁)给他转发了一封关于“某个眼科基金会某人”担忧的电子邮件。尽管他认为自己的眼药水是安全的,而且尚未与任何感染联系在一起,但他还是将自己的产品从市场上撤下。“我不想惹上法律问题,”他说。“我决定最好不卖任何东西。”一周后,他说,FDA的一名官员打电话给他。Arumugam被告知Global Pharma已同意自愿召回Delsam Pharma的人工泪液和EzriCare的产品。
佩特里斯在她的干眼商店储藏室里。摄影师:Chona Kasinger,彭博商业周刊EzriCare的律师回复基金会的一封停止和撤回信,基金会随后撤下了视频。当时,Arumugam说,有人(他不记得是谁)给他转发了一封关于“某个眼科基金会某人”担忧的电子邮件。尽管他认为自己的眼药水是安全的,而且尚未与任何感染联系在一起,但他还是将自己的产品从市场上撤下。“我不想惹上法律问题,”他说。“我决定最好不卖任何东西。”一周后,他说,FDA的一名官员打电话给他。Arumugam被告知Global Pharma已同意自愿召回Delsam Pharma的人工泪液和EzriCare的产品。
巧合的是,就在几周前,该机构已禁止了来自Global Pharma的所有进口产品。该公司还生产止咳糖浆,这种药物因冈比亚儿童死亡而受到怀疑。该公司与这些案例无关。但FDA正在调查所有来自其所谓的“关注地区”的制造商,而该公司对其记录的请求未作出充分回应。
关于Global Pharma制造的所有未过期产品的眼药水召回的公告于2月2日发布。如果FDA官员对于一个小型非营利组织如何比他们更快地警告公众有任何想法,那么没有人透露。
Petris对可怕的眼部感染特别有同感。她在2005年接受了Lasik手术后,视力减退,眼睛干涩和慢性疼痛。她于2018年成立了Dry Eye Foundation,专注于患者倡导,并邀请Brown,一直在医疗问题上为她提供建议的人,加入董事会。
最近,Petris一直在收集看起来可能不安全的眼药水。她发现并向FDA投诉的数十个品牌中,许多仍然可以在Amazon.com、Walmart或两者都有售。Petris和Brown一直在呼吁该机构不仅要打击有问题的品牌,还要修复允许它们进入市场的系统缺陷。
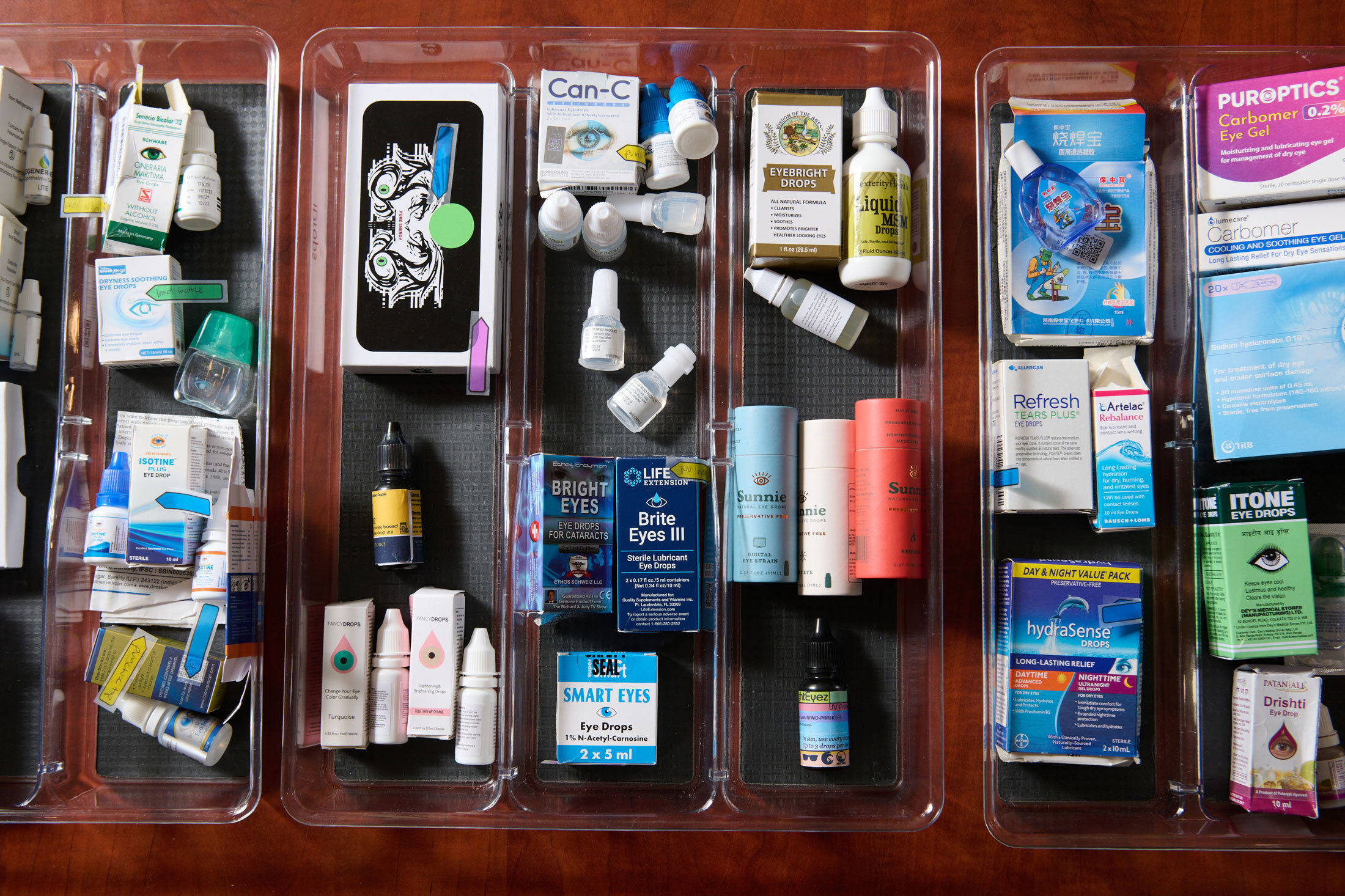 Petris的可疑眼药水收藏。摄影师:Chona Kasinger,彭博商业周刊甚至在大流行病造成大量积压之前,FDA就一直在努力检查制造工厂,特别是海外工厂。有些甚至没有向该机构注册。根据健康分析公司Pharm3r LLC的数据,自2015年以来,FDA仅检查了注册用于OTC产品的设施的52%,以及制造处方药的设施的53%。OTC设施之间的检查平均间隔为两年半。
Petris的可疑眼药水收藏。摄影师:Chona Kasinger,彭博商业周刊甚至在大流行病造成大量积压之前,FDA就一直在努力检查制造工厂,特别是海外工厂。有些甚至没有向该机构注册。根据健康分析公司Pharm3r LLC的数据,自2015年以来,FDA仅检查了注册用于OTC产品的设施的52%,以及制造处方药的设施的53%。OTC设施之间的检查平均间隔为两年半。
2月20日,FDA来到了靠近金奈的Global Pharma工厂,两名检查员进行了将近两周的审查。他们的14页报告揭示了如此多的缺陷,以至于英国无菌制造专家Tim Sandle称之为他见过的最长之一。他说,这是“一个薄弱的质量文化”迹象。
无菌加工需要特殊的房间,其中空气流动是单向的,并经过过滤,以便微粒不会沉积在任何地方。前往美国的Global Pharma批次来自一个听起来适合家庭翻新真人秀的房间;墙上露出钉子,密封胶开裂。当检查员在灌装机的碗周围擦拭布时,它擦出了褐色的油腻沉积物。
一些重要职位的员工尚未接受培训。一名质量保证经理发布了带有预先填写清单的批次。Global Pharma尚未确定用于灭菌溶液的过滤器的有效性。
在支持Brown理论的一个部分中,报告指出Global Pharma从一家未透露的供应商购买了瓶盖,并未对其进行无菌测试。也没有对容器的密封系统进行任何测试,而是依靠目视检查是否有泄漏。Rajendran没有同意接受本文的采访,但在WhatsApp交流中,他说“忘记所有瓶子”,重申FDA对封闭眼药水瓶进行的测试并未发现假单胞菌污染。(这些测试显示了尚未完全确定的细菌污染。)他说他的公司正在与FDA合作,“他们也对我们的行动做出了回应和反应。”否则,他拒绝置评。
“美国公众应该知道没有人在关注,”斯坦福大学医学院的教授凯文·舒尔曼说。“FDA没有足够的资源来做到这一点并不是他们的错。但他们不应该假装他们可以。”他说,试图监控全球使用几代前设计的国内市场检查程序是不现实的,国内市场可以轻松完成未经通知的审查。
FDA也没有足够的资源进行足够的测试。“他们偏离了他们保证瓶子里的东西实际上在瓶子里的基本使命,”前FDA官员大卫·戈特勒说。他认为FDA应该在药物进入该国之前测试每一批;如果机构无法支付,进口商应该支付。药品购买者——零售商、批发商、药店——也可以测试他们购买的药品,尽管FDA已经反对这样做,称这些结果可能不可靠。
对于眼药水造成的所有伤害,如果超级细菌在其他类型的非处方药中未被发现,那么造成的伤害可能会更严重,华盛顿州立大学传染病流行病学家埃里克·洛夫格伦表示。与眼药水一样,可能需要数月时间才能追踪到来源。“你不会看到一个标题说今天有成千上万人死亡,”洛夫格伦说。“只是每个人,到处都会变得稍微不那么安全。”
 美人鱼眼泪的包装,这是布朗和佩特里斯制造的一个虚假眼药水,用于测试FDA。来源:NIH美国食品药品监督管理局药物评价与研究中心主任帕特里齐亚·卡瓦佐尼在四月份向一家游说团体做报告时承认“我们在确保非处方药品质量方面存在一些漏洞”。拜登政府最新的预算请求包括一个机构提案,将解决眼药水召回中确定的主要缺陷之一:要求首次生产非处方产品的制造商在销售前提前六个月通知FDA,可能允许进行检查。
美人鱼眼泪的包装,这是布朗和佩特里斯制造的一个虚假眼药水,用于测试FDA。来源:NIH美国食品药品监督管理局药物评价与研究中心主任帕特里齐亚·卡瓦佐尼在四月份向一家游说团体做报告时承认“我们在确保非处方药品质量方面存在一些漏洞”。拜登政府最新的预算请求包括一个机构提案,将解决眼药水召回中确定的主要缺陷之一:要求首次生产非处方产品的制造商在销售前提前六个月通知FDA,可能允许进行检查。
据彭博新闻报道,政府还在考虑更广泛的方式来解决药品质量问题。可能的措施包括:增加未经通知的检查和药品进口检测,以及为制造商制定新的质量评分。所有这些都需要资金。即使支持者们表示,满足政府明年对FDA预算增加10%的要求也将是具有挑战性的。
追究造成感染的责任人也比看起来更困难。现在失明的佛罗里达退休者奥利瓦和只能用一只眼睛的南卡罗来纳人马特雷,是起诉Global Pharma、EzriCare或Delsam Pharma的几个人之一。分销商和制造商可能会在法庭上互相推卸责任,就像他们在法庭之外所做的那样,而Global Pharma可能完全可以逃避美国法律体系的管辖。一些诉讼还将亚马逊和沃尔玛等零售商列为被告,他们通常通过声称分销商有错来避免在有缺陷产品案件中承担责任。等等。
泰米尔纳德邦的药品官员似乎已经免除了Global Pharma的责任。他们在三月份表示,在该公司的工厂进行的抽样检测中没有检测到假单胞菌。按照印度的惯例,他们没有分享他们检查的结果。在四月份退休前不久接受采访时,该邦首席药品监管官P.V.维贾亚拉克什米拒绝回答与检查相关的大多数问题,因为她表示这些信息是机密的。然后她称问题的语气是不尊重的,并结束了采访。她的继任者没有回应采访请求。
在美国禁止进口几周后,Global Pharma通过斯洛伐克卫生当局的检查,他们表示其工厂符合欧盟制造非无菌药品的标准。ImportGenius的记录显示,葡萄牙和法国的分销商今年已收到来自Global Pharma的货物,其中包括治疗胃酸逆流的药丸、抗组胺药和阴囊瘙痒霜。
当涉及到美国经销商时,FDA可能会与司法部合作,提起刑事诉讼,可能包括罚款和监禁。曾代表食品细菌爆发受害者的律师比尔·马勒说:“我可以看到他们会对产品销售商进行严格审查,并就他们所知道的事情提出很多非常困难的问题。他们是否进行了任何调查?他们是否了解产品?”
 另一种假眼药水“Ocean Tears”,布朗和佩特里斯提交给FDA。来源:NIH检查员于三月份访问了位于新泽西州莱克伍德工业园区的EzriCare仓库,并根据提供给Bloomberg Businessweek的文件,报告称其制造商缺乏质量控制和监督。EzriCare的另一位律师、前FDA官员本杰明·英格兰回应称,该公司已经停止分发任何带有EzriCare标签的产品,并将销毁其库存的乳霜和药膏。他告诉FDA,“人工眼泪的配方、包装系统设计和制造”是由Global Pharma而不是EzriCare执行的。
另一种假眼药水“Ocean Tears”,布朗和佩特里斯提交给FDA。来源:NIH检查员于三月份访问了位于新泽西州莱克伍德工业园区的EzriCare仓库,并根据提供给Bloomberg Businessweek的文件,报告称其制造商缺乏质量控制和监督。EzriCare的另一位律师、前FDA官员本杰明·英格兰回应称,该公司已经停止分发任何带有EzriCare标签的产品,并将销毁其库存的乳霜和药膏。他告诉FDA,“人工眼泪的配方、包装系统设计和制造”是由Global Pharma而不是EzriCare执行的。
检查员还访问了布朗克斯的阿鲁穆甘药房,并因对Global Pharma的监督不力而被指控。“我无法从这里监控,”阿鲁穆甘从柜台后说道。FDA发现他在2021年夏季的大部分时间里将一些眼药水存放在一个没有温度监控的公共存储设施中。报告称,自召回以来,至少有五起与Delsam Pharma产品相关的眼部感染投诉被提交,而该公司没有按照FDA的要求跟踪不良事件的程序。“我交给我的律师处理了,”阿鲁穆甘说。感染情况严重,但尚未被确认为铜绿假单胞菌。
五月份,干眼基金会无法抵挡对机构防护栏的进一步测试。Petris和Brown成立了一家名为Ocean Tears LLC的公司,据说是眼药水制造商。他们支付了大约500美元来建立这家公司并获得Dun & Bradstreet编号,这是FDA软件要求那些列出新的OTC产品的人必须提供的业务标识符。他们找到了一种方法,在标签上包含一个虚构的专有物质作为其中的一种非活性成分。这个列表 顺利通过了系统。
他们变得更加大胆,又发明了另一种眼药水,称之为美人鱼之泪。他们写道,它的作用是“保护眼睛免受盐水刺激”和“让您在水下看起来像美人鱼一样”。在标签上的警告中,他们包括了这一条:“这是一种未保存的眼药水,包装在标准眼药水瓶中。”任何意外吞下它的人都被建议尽快寻求医疗帮助,最好是在水族馆。
Petris和Brown也没有遇到任何问题,然后,两个月后,在彭博社的询问之后,FDA阻止了他们的虚假公司列出新产品。不过,如果他们想要生产和销售他们的美人鱼之泪,似乎没有人会阻止他们。